唯一器械标识(Unique Device Identification,缩写UDI)是对医疗器械在全程供应链中的唯一身份标识。通过医疗器械唯一标识建立医疗器械信息化追溯系统,可以实现医疗器械不良事件报告、产品召回及追踪追溯等实施应用。在信息时代背景下,UDI是国际医疗器械监管的先进手段,是医疗器械实现全球可追溯的“通用语言”。 目前,欧美部分国家都已经制定UDI政策法规,规定或强制要求在本国销售、流通的医疗器械上必须实施UDI标识。在全球范围内,UDI实施的时间表和截止日期因市场和产品而异,在一些国家已多次修订。本次,慧铭佳收集到了全球部分国家UDI合规实施的截止日期,供企业参考。更多信息我们也将继续更新。
目前,欧美部分国家都已经制定UDI政策法规,规定或强制要求在本国销售、流通的医疗器械上必须实施UDI标识。在全球范围内,UDI实施的时间表和截止日期因市场和产品而异,在一些国家已多次修订。本次,慧铭佳收集到了全球部分国家UDI合规实施的截止日期,供企业参考。更多信息我们也将继续更新。
目前全球范围内实行UDI要求的国家/地区有:
· 美国

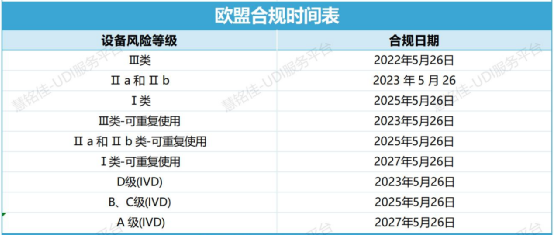
· 欧盟
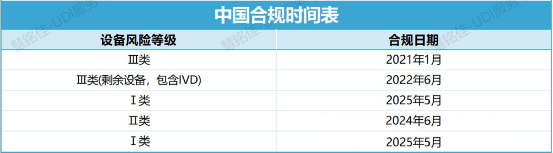
· 中国
· 澳大利亚

· 巴西

· 沙特阿拉伯

· 中国台湾

· 加拿大
加拿大卫生部已经提出了一个UDI框架,框架紧密地基于来自IMDRF的UDI指南。目前的提案要求所有设备都贴上UDI标签,I类低风险设备除外。加拿大卫生部打算开发一个UDI数据库,或者修改现有的医疗设备活动许可证列表数据库(MDALL)以容纳UDI数据。
预计和大多数国家一样,加拿大也将根据需要添加少量额外的UDI数据属性。
· 印度
2021年底,印度卫生和家庭福利部推迟了UDI在印度的实施要求,新的截止日期尚未出台。之前2017年《医疗器械规则》第46条规定,要求在2022年1月1日之前,对批准在印度制造、销售、分销或进口的医疗器械贴上UDI标签。关于如何在设备上显示 UDI的详细信息,以及UDI需要包含那些特定信息,尚未发布。
· 日本
2008年,日本厚生劳动省(MHLW)发布了“医疗器械上放置标准代码(条形码标记)的指南”。这在鼓励器械包装上使用条形码方面取得了成功,但在器械上的直接标记仍然非常有限。
2016年JFMDA(日本医疗器械协会联合会)出版了《医疗器械UDI操作手册》,进一步鼓励在特定类型的医疗器械上直接标记条形码。
2019年,《药品和医疗器械法》被称为PMD法案,经过修订,其中包括医疗器械包装的UDI标签要求。自2022年12月起生效,并根据器械类型逐步实施,医疗器械的即时容器/包装材料/零售包装应要求使用基于国际标准的条形码标签。具体地说,预计条形码将以病人使用单位显示在每一个药品和医疗器械上。此外,应推广在临床环境下使用条形码标签的安全措施,以及由MAHs在数据库中注册生产信息。
· 新加坡

· 韩国


点击链接查看更多全球UDI实施要求 ⬇️ ⬇️ ⬇️
出口欧盟要求提交的Basic UDI-DI,应该如何申请、编写?
基于GS1标准的UDI系统实施常见问题——欧盟UDI实施步骤建议
免责声明:转载文章观点仅代表原作者本人,如有侵权请联系删除,我们将及时处理以保障双方权益。
 UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司
UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司 