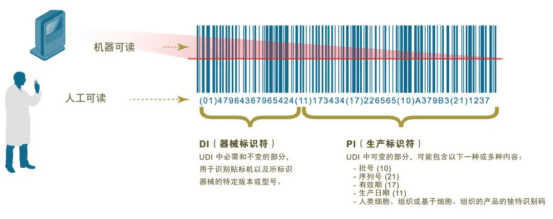
医疗器械唯一标识(Unique Device Identification,缩写UDI)是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。全球采用统一的、标准的UDI有利于提高供应链透明度和运作效率;有利于实现信息共享与交换;有利于不良事件的监控和问题产品召回,提高医疗服务质量,保患者安全。
2019年7月,我国开始推进UDI试点工作,并已先后在天津、福建、北京、海南等多个省市推进落实。在医疗器械唯一标识大趋势下,国内UDI点范围的逐步扩大。日前,国家药监局、卫健委、医保局三部门联合印发的《关于做好第二批实施医疗器械唯一标识工作的公告》明确,自2022年6月1日起,生产的医疗器械应当具有医疗器械唯一标识(UDI),即日起所有第三类医疗器械都将开始实施“实名制”。按照要求,未按要求填报产品标识(UDI)的,注册申报资料将不予签收。这也意味着,不使用UDI的第三类医疗器械将无法注册上市。
但与此同时,实施UDI这样的新任务对于大多数企业而言,无异于摸着石头过河,UDI在生产、流通、使用、监管和服务商选择等环节存在的诸多难点也日渐凸显。
一 生产环节:周期长 编码难
申报复杂 产品交付周期长
UDI关系到三医联动以及全生命周期追溯流通,在实际申报过程中分类复杂,相关法规多、杂、且暂未细化,申报过程中任何一个细节的不合规范,都可能需要耗费更多的时间精力去查错和修改。或者为后续正常运营带来隐患。同时,创建和实施UDI是一个较为长期的过程,一般来说需要一年到一年半才能完成整个流程。
编码投入成本高
生产企业是负责具体实施UDI的主体,但UDI的实施给生产企业增加了工作量,尤其是对生产企业的质量管理体系、器械标签管理等方面产生了影响,从而在一定程度上增加了企业的管理成本。
根据EUcomed 关于2020年前企业UDI建立所耗费的资金调研,整个产业估耗费涉及10亿欧元。我们认为,前期生产企业端的编码投入占据了主要部分。
编码管理维护成本高
有些医疗器械企业自行编辑PI编码,但随着编码量增大,还存在数据存储、查询、流通、应用等问题,需要企业花费较大的人力和物力来完成。而且当企业自行保管编码数据,但在使用过程中如维护不当,易造成数据错误、错漏、版本不统一等情况,为后续检查带来麻烦。这种麻烦会导致维护成本和质量成本的大大增加,而且,该方式需要安排专员学习、使用、保管相关编码规则和数据,这些都会增加企业维护成本。
二 流通环节:UDI数据系统不统一 编码应用效果受限
目前,由于业内缺少统一的UDI数据系统,导致只有生产企业单方面掌握产品信息与UDI的对应关系,而经营企业、物流企业和医疗机构需要建立对应的数据库才能运用UDI,UDI编码的广泛应用受限。
从经营企业来看,医疗器械经营企业无法直接解析和使用上游环节的生产企业的UDI,而是使用自定义条码,造成其工作量的增大以及运营成本的提高;在订单管理、仓储、运输等环节的转换可能导致器械信息的遗漏;订单环节更新慢,不能及时供应给下游的医疗机构等。
从医疗机构来看,由于规则不统一,源头编码难以实现“一码到底”,导致编码的应用不成体系,信息无法共享,编码应用效果受到限制。
三 使用环节:识读设备系统可能不兼容
使用环节的问题主要体现在医疗机构对于医疗器械UDI的管理还存在一定的不足。
目前,医疗机构识读设备系统未兼容,仍存在医疗机构不能识别制造商的条码、无法形成条码化管理系统的现象。医疗机构在采购过程中未对企业的经营资质进行查询,会导致购买的医疗器械无安全有效保证。
在医疗器械使用环节中运用UDI,可实现对医疗器械的现有状态进行查询,便于订货、补货以及快速查找医疗器械,追踪医疗器械及使用患者等相关信息。
然而,如果UDI在使用环节中不流通,就可能出现临床上一些医疗器械条码只能作为资料保存在病案中,并没有很好地进行实践应用,使临床人员对器械的功能不熟悉,保养不当。

四 监管环节:全网追溯监管难以实现
医疗器械不良事件、再评价以及召回是医疗器械上市后监管的重要举措。
虽然上市前的监管已经对风险进行了评估,但是医疗器械本身还会具有一定的剩余风险,且在医疗器械的全生命周期风险会一直存在。
上市后监管由监管部门负责,利用医疗器械不良事件监测系统对不良事件进行上报及追踪。
然而,由于UDI分享数据渠道的封闭性和常规物流信息系统不兼容,目前无法完全实现医疗器械电子追溯体系监管。
一方面,现有的系统及接口均未采用国际、国内通用物流信息交换标准,监管部门无法与物流、供应链、医院等实现信息系统互联互通。
另一方面,追溯和监管都只局限于区域和部分参与单位,无法实现全过程、全网追溯。
五 UDI服务商的风险:是否专业
在国家局大力推动医疗器械唯一标识的大背景下,随着国家局UDI试点截止日期越来越近,越来越多的企业希望把实施效率排在更优先位置。这就要求企业实施UDI需要首先考虑合规问题,通过医疗器械生产、流通、使用等各环节对医疗器械的精准识别,从而实现对产品的有效监督和管理。
但没有专家指导的服务商,往往合规方面出现问题的风险会更大。
在确保合规的基础上,也要注意要选择要有专业服务的机构,很多企业由于服务商缺少相关配套服务,在实施过程中会出现了较多问题,比如UDI生成软件不好用/难以升级,使用过程无人指导,后期没有售后、维护不力等。
免责声明:转载文章观点仅代表原作者本人,如有侵权请联系删除,我们将及时处理以保障双方权益。
 UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司
UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司 