UDI 由政策强制推动,目前第三类医械产品注册备案必须要有UDI。同时一二类产品也需要提早布局。
目前已经有部分省市如北京、天津、海南、山东、福建等地陆续开始推行二类医疗器械实施UDI的工作。需要在这些省市流通的产品,都必须实施UDI。全国各省市共同实施二类医疗器械唯一标识(UDI)的要求,预测也会在未来三五年内完成。
在实际流通过程中,越来越多已实施UDI医院端也会要求一、二类医疗器械产品有UDI码。
有出口需求的医疗器械产品,也需根据出口国家/地区的的相关政策法规来完成相应医械产品的UDI实施。比如目前美国二类、三类都已经要求实施UDI,一类和其他未分类器械要求在2022年12月完成UDI实施;欧盟UDI三类要求实施UDI标签的合规截止日期是2022年5月26日,二类将在2023年5月26日完成实施,其他设备类别将在2027年5月26日之前截止。
与此同时,UDI实施对于企业而言,存在实施难度大、实施周期长等难点。到当国家及各省市正式推进 UDI 时,如果企业时间不足无法及时完成相关工作,将导致企业产品无法如期上市销售。 因此有相关实施规划的企业,需预留好足够的实施时间,建议尽早完成UDI实施。
选对正确的发码机构
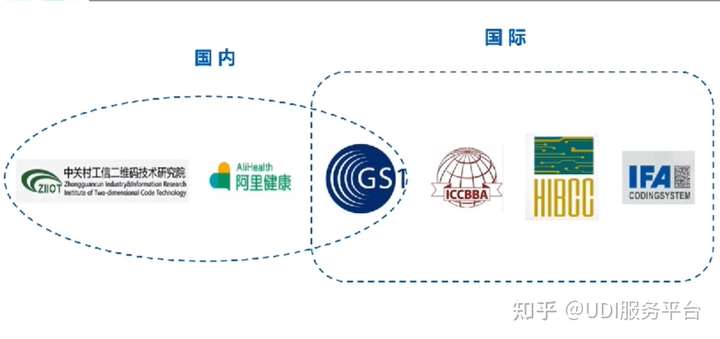
对于国内企业而言,有目前国家药监局认可的三家UDI发码机构可供选择,分别是中国物品编码中心(GS1)、中关村工信二维码技术研究院(ZIIOT)和阿里健康科技。这三家均满足国家药监局的需求。
目前,GS1是国内企业的主流选择(占比超9成),它也是国际上通用度最好的编码语言,是目前国内唯一能同时满足中国、欧盟和美国的要求的编码,而一些国家如阿根廷、巴西、日本、西班牙、新加坡等,国内仅支持GS1。
尤其是有出口需求或规划的企业,建议发码机构选择GS1,一方面能够减少编码转化的成本,另一方面能够降低转码可能带来的识别错误。以此来更好兼顾到海外监管部门的要求。
政策合规风险
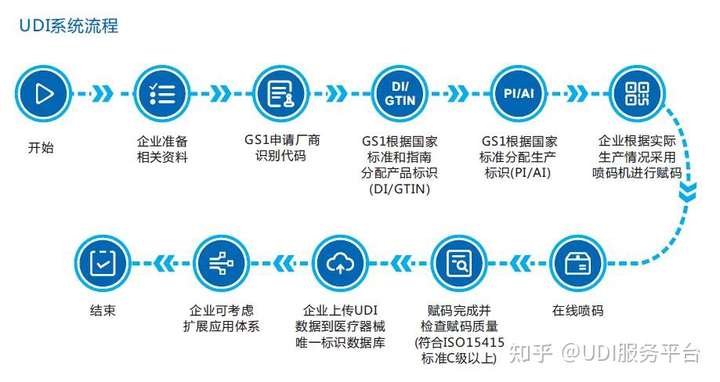
UDI在实际申报过程中分类复杂,相关法规多、杂、且暂未细化,申报过程中任何一个细节的不合规范,都可能需要耗费更多的时间精力去查错和修改。于企业而言,如果自行实施UDI,需要组建实施团队,梳理产线,负责注册的人员需要深度学习和把握政策法规,实时追踪 UDI 相关法规最新进展,让团队及时跟上政策作出相应行动。
编码合规风险
目前在我国 UDI 仍属于新兴领域,很多企业实施产品编码赋码没有软件或设备支撑,企业在具体实施过程中经常面临许多具体问题。如果没有正确理解 UDI 相关政策,不了解 UDI 实施编码规范就盲目进行 UDI 实施,将导致细节实施不规范,存在较大的运营风险。
数据管理维护风险
有些医疗器械企业自行编辑PI编码,但随着编码量增大,还存在数据存储、查询、流通、应用等问题,需要企业花费较大的人力和物力来完成。而且当企业自行保管编码数据,但在使用过程中如维护不当,易造成数据错误、错漏、版本不统一等情况,为后续检查、维护增加企业维护成本。
赋码设备需正确选择

UDI 与企业生产直接挂钩,如果编码、识读出问题可能会导致企业产品整批返工。
在实际生产过程中,不同生产线、不同产品需要对应不同的赋码设备。医疗器械赋码方式主 要有高解析喷码、可变数据印刷、热转印、贴标、激光打标以及条码打印方式等。
由于产品通常是多层级包装,不同包装之间涉及的赋码技术可能也不相同,所以在针对 UDI 搭建赋码设备时,需要对产品和产线情况有清晰的了解,才能避免因设备与场景选择不当导致赋码不合规,或者降低产线生产效率。
需选对专业的服务商
如何选择专业的服务商,也是企业需要考虑的问题。所以无法确保UDI实施合规性的服务商就可以直接排除。如何正确梳理产品DI,高效率协同企业完成合规实施,需要深厚的政策解读能力和UDI体系建设能力。更建议企业选择GS1官方推荐的标准服务提供商。
在确保合规的基础上,也要注意要选择要有专业服务的机构,很多企业由于服务商缺少相关配套服务,在实施过程中会出现了较多问题,比如UDI生成软件不好用/难以升级,使用过程无人指导,后期没有售后、维护不力等问题。

关于我们
慧铭佳-UDI服务平台是药监局承认,中国物品编码中心(GS1)的推荐的标准服务提供商,为企业提供便捷高效的一站式UDI申报平台。慧铭科技团队专注医疗行业,致力于为医疗器械企业提供UDI实施的各项服务。目前已服务全国各地300余家企业机构。
我们能为您提供:
一站实施:编码中心自营渠道,账号贯通全流程,减少系统间繁琐跳转;
官方发码:中国物品编码中心直接发码,无第三方中转,确保编码合规、全球通用且唯一;
专线客服:7X24小时专线客服,一对一提全流程专业解答,保障企业高效完成实施;
高效编码:无需组建编码团队,企业人员通过简单培训即可完成“最低成本、最快速度、最简操作”完成UDI赋码全流程操作;
数据管理:为每家企业提供千万存储能力的UDI数据库,功能强大且调用方便;
专业检测: 标签模板保障签规样式,聚合式打印方案确保产品标签顺利通过使用检测;
学习交流:定期举办专项培训课程,行业权威进行政策法规、标准解读,监管部门、生产企业、医疗机构现身说法;
按需拓展:充分发挥编码中心供应链数据应用优势,为后续企业物流、医院采购、科室应用、病患查询等场景所需追溯、防伪、防窜等应用提供云端升级。
免责声明:转载文章观点仅代表原作者本人,如有侵权请联系删除,我们将及时处理以保障双方权益。
 UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司
UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司 