一、UDI的组成
医疗器械唯一标识,简称UDI(Unique Device Identifier),是对医疗器械进行唯一性识别的一组代码。UDI由产品标识DI(Device Identifier)和生产标识PI(Production Identifier)组成,DI部分记录与产品相关的静态信息;PI部分则记录与生产过程相关的动态信息。
UDI由产品标识(DI)和生产标识(PI)两部分组成:

二、 UDI中的产品标识(DI)含义
DI是设备标识符,具备全球唯一性,是UDI编号的静态部分。DI信息包含有由企业编码和产品ID。这其中,企业编码是由备案人申请,由符合我国医疗器械编码规则和标准的发码机构发出的,具备唯一性的编码;产品ID则是一段包含具体产品名称、包装等级、规格型号的编码。
下图中黄色框线内的GTIN部分就是我们的DI,AI部分是我们的PI。不同号段分别代表:
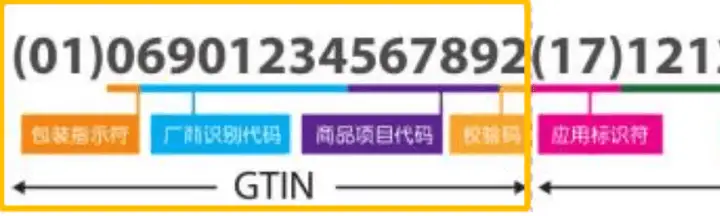
DI 指示符:(01)为 DI 指示符,(01)表示后面的字符为产品DI。当UDI中同时包含DI和PI时,需要在GTIN前增加应用标识符(01)。
包装识别符:由 1 位数字组成,0-9,0 代表基础包装或一层包装,1 代表二层包装,以此类推;
厂商识别代码:由 7至10 位数字组成;由中国物品编码中心分配。厂商识别代码的前3位代码为前缀码,国际物品编码组织分配给中国物品编码中心的前缀码为690〜699。
商品项目代码:2至5 位数字组成,由注册人/备案人、生产企业根据相应编码原则编制,该代码本身无具体含义,与分类无关,不代表任何信息。
校验码:为1位数字,用于检验译码正确性。算法详见GB 12904《商品条码 零售商品编码与条码表示》附录B,也可通过中国物品编码中心网站校验码计算工具在线生成:输入包装指示符和要校验的商品条码后,会自动生成校验码。
三、如何使用GS1标准编制UDI-DI?
UDI-DI可采用全球贸易项目代码(GTIN)进行标识。全球贸易项目代码(GTIN)由GS1厂商识别代码、商品项目代码和校验码组成,共有GTIN-8、GTIN-12、GTIN-13和GTIN-14四种结构,见下图。
产品标识的代码结构:
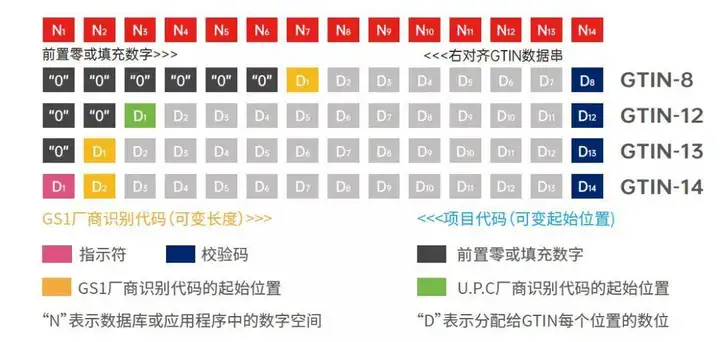
编码生成产品标识数据载体时,所有结构的GTIN必须为14位数据字符串,长度小于14位的GTIN必须在开头填充零作为补位(EAN-13除外)。补零不会将GTIN-8、12或13变为GTIN-14。
医疗产品GTIN常见结构有12、13和14位结构,国产产品常用结构为GTIN-13和GTIN-14。

其中GTIN-13用于单个销售单元包装,规则详见GB12904《商品条码零售商品编码与条码表示》。
GTIN-14一般用于多个销售单元的组合包装,规则详见GB/T16830《商品条码储运包装商品编码与条码表示》。此外,医疗器械GTIN的分配还应遵循《GS1医疗产品GTIN分配指南》,也可使用医疗GTIN分配在线决策工具帮助判断是否需要分配新GTIN。
四、企业在编制UDI-DI时,应遵循哪些原则?
1、优先原则:根据监管部门的要求,优先分配代码;
2、合规原则:根据代码发布机构的标准和规范分配代码;
3、唯一性原则:同一规格型号的产品原则上应赋予一个最小销售单位产品标识,不同规格型号的产品应赋予不同的产品标识,同一规格型号不同产地的产品可赋予不同的产品标识;不同的产品标识应赋予不同的包装规格;
4、一般来说,产品的基本特征包括产品名称、商标、类型、规格、数量和包装类型等产品特征。医疗器械注册人/备案人可以根据产品特点和自身产品管理需求,为产品分配唯一的DI;
5、如果最小销售单位包含一个以上使用单位相同的产品,产品标识应分配给使用单位;
6、稳定性原则:DI一经分配,如果产品的基本特性没有改变,则应保持不变。
五、有哪些变化时,医疗器械将需要新的UDI-DI?
对于以下情况,需要分配新DI:
1、监管部门或医疗器械唯一标识数据库有新的或明确的管理要求时,需分配新DI;
2、发码机构的标准和规范有新的要求,需分配新DI;
3、产品注册备案时,提报的某项特征信息变化,可能对使用安全、临床应用产生影响,或会导致对安全及风险管理产生模糊的时候,需分配新DI;
4、产品注册备案时,提报的构成产品贸易项目特征的任何要素发生变化,则需分配新DI。

点击链接查看更多UDI编制规则 ⬇️ ⬇️ ⬇️
免责声明:转载文章观点仅代表原作者本人,如有侵权请联系删除,我们将及时处理以保障双方权益。
 UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司
UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司 