UDI标识可能出现在外包装或运输包装上,例如盒子、袋子、纸箱等,便于扫描和识别。这样的情况下,企业在去着手做UDI实施具体工作时,经常会有这样的疑问:哪些包装上需要有UDI码?

根据《医疗器械唯一标识系统规则》第十二条:注册人/备案人应当选择与其创建的医疗器械唯一标识相适应的数据载体标准,对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识数据载体,并确保在医疗器械经营使用期间唯一标识数据载体牢固、清晰、可读。
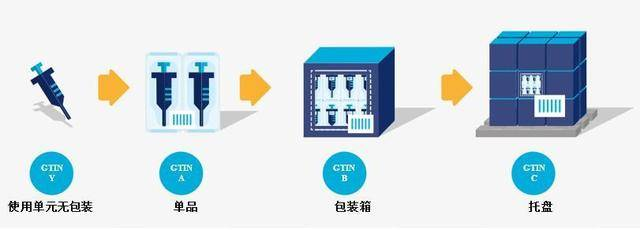
也就是说,需要有UDI的包装包括“最小销售单元和更高级别的包装或者医疗器械产品”。什么是“最小销售单元”和“更高级别的包装”呢?是否还有其他包装也需要有UDI 呢?一起来了解:
1、最小销售单元
《医疗器械唯一标识系统规则》将UDI制度实施中赋码的最低包装等级确定为医疗器械的最小销售单元。对于最小销售单元,它是指直接供应给医疗机构或消费者的最小包装单元,例如一盒、一袋、一支等。在UDI实施的过程中,最小销售单元的定义非常重要,因为它是在UDI数据库创建记录和维护信息的基,上承各级包装,下启使用单元。
对于“最小销售单元”,目前国药监没有公布定义或行业标准可参考,一般需要企业根据产品及市场业务需要自行确定。在这个过程中,生产企业需要尽可能考虑产品到达最终用户前,可能使用到的最小交易单元。
2、更高级别包装
更高级别包装是指包含多个最小销售单元的包装,例如中箱、大箱等。更高级别包装的UDI码主要是为了满足产品在供应链环节的任何位置都可以进行定价、订购和付款。这种情况下用于生产企业定价、客户订购和付款的包装,都需要有UDI。
3、使用单元标识
除了“最小销售单元”和“更高级别的包装”,在一些场景下,还需要对医疗器械产品的使用单元分配DI。使用单元产品标识(UoU DI)是分配给医疗器械使用单元等级的标识符。FDA关于“使用单元产品标识”的定义是:使用单元产品标识(UoU UDI-DI)是分配给使用单元等级医疗器械的标识符。当在器械的使用单元等级上没有标识UDI的情况下,需要分配UoU UDI-DI,其目的是为了将器械使用与患者相关联。
目前我国UDI实施仅对最小销售单元及其以上的产品层级提出了要求,并没有对使用单元产品标识的应用做出明确的要求和限制,但这仍然是一个值得关注的问题,对于是否需要为医疗器械使用单元分配UoU UDI-DI,企业需要考虑以下因素:
① 出口需求:国内出口美国的医疗器械,需要遵循美国的UoU UDI-DI的施行要求。
② 医疗供应链需求:随着国家高值医用耗材改革,医院对医用耗材精细化管理的要求逐步提升,对使用单元赋码是一种趋势,不仅针对高值医用耗材,对于部分低值耗材也存在必要。
③ 医保要求:医疗器械临床使用单元有码对于能够单独进行结算的医用耗材十分重要,也是当前实施过程中医疗器械使用单位反映比较集中的问题。
与之同时,目前我国UDI制度还在不断推进和完善,未来也不排除会增加对使用单元产品标识的要求。
但在实际实施过程中,医疗器械使用单元UDI实施与一般的UDI实施流程相比难度更高,且容易出现合规与实现单个医疗器械扫码结算无法兼顾的问题。企业在医疗器械使用单元UDI实施过程中需要综合考虑合规要求、医疗供应链需求、医保要求和实施成这些因素。
为精准满足企业实施UDI的具体需求,慧铭科技UDI服务平台提供UDI咨询指导、UDI服务平台一站式解决方案、生产/经营/医院端、追溯平台等一系列服务,企业可通过下方卡片拨打电话或添加实施专家微信,获取更多实施建议
免责声明:转载文章观点仅代表原作者本人,如有侵权请联系删除,我们将及时处理以保障双方权益。
 UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司
UDI服务平台-慧铭佳UDI-北京慧铭佳科技有限公司