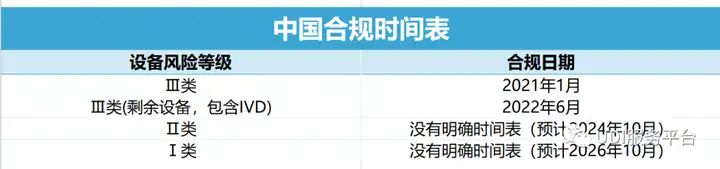
自今年6月1日起,所有三类医疗器械都需要实施UDI,按照要求,不使用UDI的第三类医疗器械将无法注册上市以及正常流通。
那么目前,一二类医疗器械产品有必要提前实施UDI码吗?
之前我们跟大家分享了UDI全球合规时间进度。目前国家药监局暂未公示实施二类医疗器械UDI工作的具体时间节点,但均鼓励生产企业尽早完成产品 UDI 的赋码工作。在这样的指导思想之下,一些省市积极推进了相关工作,诸如北京、天津等地已经明确要求二类企业实施,安徽、江苏等地也已经表态要鼓励和推动第二类/第一、二类医疗器械实施UDI。
从医疗器械产品流通的角度看,在这些已经明确要求二类实施的省市,二类医疗器械需要实施UDI才能够流通使用;其他省市相应的二类器械若想在这些省市流通,也需要实施UDI才能顺利实现流通。一起来看看各省政策: 一、明确要求二类医疗器械企业实施的省市(按照发文时间先后):
- 福 建
2021年3月3日,福建省药监局在《关于全面推进医疗器械唯一标识系统建设工作的通知》中,明确要求自2021年07月 01日起,新申办和再注册的Ⅱ类医疗器械注册人应当将其产品标识上传至国家医疗器械唯一标识数据库,并在产品上市销售前完成赋UDI码工作。

- 宁波
2021年06月10日,宁波市市场监督管理局在印发的《宁波市市场监督管理局全面推进医疗器械唯一标识“赋码溯源” 工作方案》中提到:
进一步扩大医疗器械唯一标识的应用范围,实现全市二类以上医疗器械生产企业、三级以上(三甲、三乙)医疗机构全覆盖。
鼓励医疗器械注册人、备案人生产的第一类医疗器械参与试点。
2021年11月1日-2022年6月30日。全市所有第二类以上医疗器械生产企业完成唯一标识的赋码、数据库上传和数据维护,三级以上医疗机构实现赋码产品的扫码解析运用。
进一步扩大医疗器械唯一标识的应用范围,实现全市二类以上医疗器械生产企业、三级以上(三甲、三乙)医疗机构全覆盖。
鼓励医疗器械注册人、备案人生产的第一类医疗器械参与试点。
2021年11月1日-2022年6月30日。全市所有第二类以上医疗器械生产企业完成唯一标识的赋码、数据库上传和数据维护,三级以上医疗机构实现赋码产品的扫码解析运用。

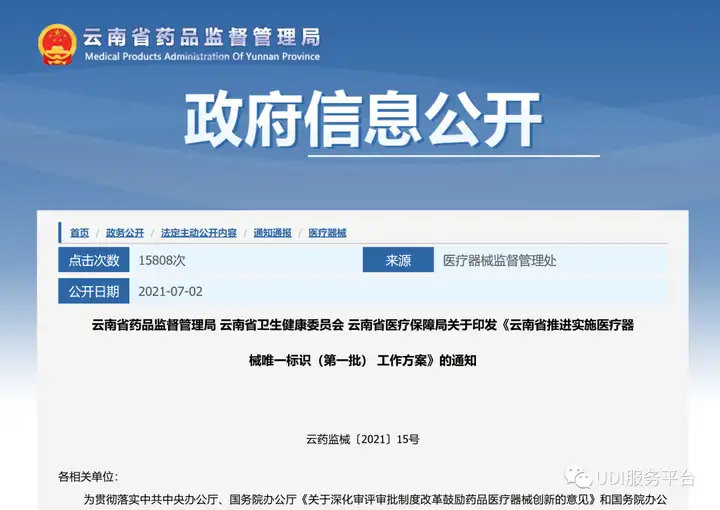
- 云南
2021年7月2日,云南省药监局发布《云南省推进实施医疗器械唯一标识(第一批)工作方案》,将医疗器械唯一标识实施品种确定为第三类和部分第二类医疗器械。明确规定了各推进唯一标识的实施步骤及任务与时间节点。要求医疗器械注册人需根据产品特点和经营使用需求,选择合适的载体、管理手段与追溯层级,将医疗器械唯一标识应用在全生命周期管理中。并在2021年12月31日前完成。
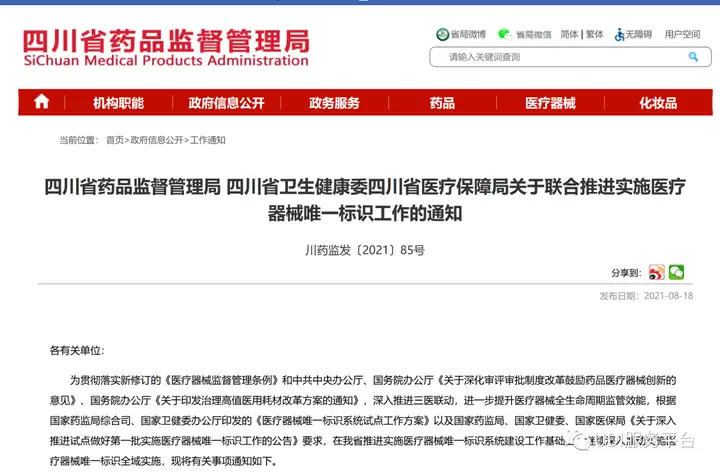
- 四川
2021年8月18日,四川省药监局、省卫建委、省医保局三部门联合下发的《关于联合推进实施医疗器械唯一标识工作的通知》中提到:
实施唯一标识品种为全省医疗器械生产企业注册生产的全部第三类医疗器械品种及《第一批国家高值医用耗材重点治理清单》内品种。鼓励本省医疗器械生产企业将第二类医疗器械纳入实施范围。
自2022年1月1日起,医疗器械生产企业申报第二类医疗器械产品注册(首次注册、延期注册和变更注册)时,要将产品的最小销售单元的DI一并填报。
实施唯一标识品种为全省医疗器械生产企业注册生产的全部第三类医疗器械品种及《第一批国家高值医用耗材重点治理清单》内品种。鼓励本省医疗器械生产企业将第二类医疗器械纳入实施范围。
自2022年1月1日起,医疗器械生产企业申报第二类医疗器械产品注册(首次注册、延期注册和变更注册)时,要将产品的最小销售单元的DI一并填报。
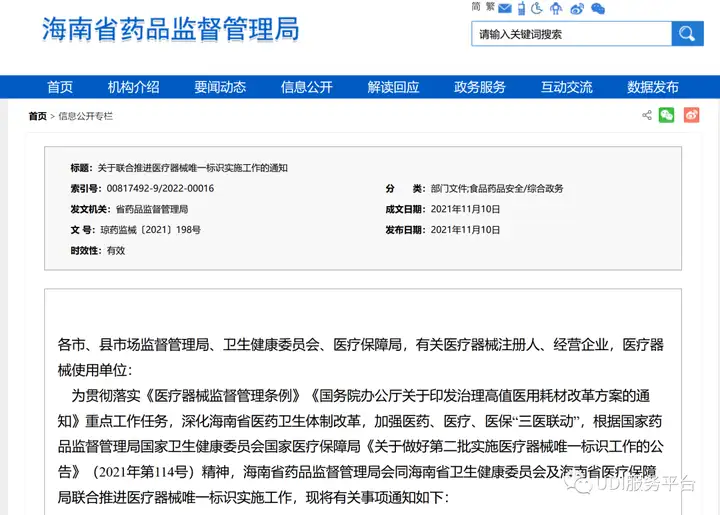
- 海南
2021年11月10日,海南省药监局在《关于联合推进医疗器械唯一标识实施工作的通知》提到:
力争实现唯一标识在生产企业和产品品种的“双覆盖”,即:全省所有第三类、第二类生产企业全覆盖以及全省第三类、第二类品种全覆盖,同时鼓励第一类器械生产企业试点。
2021年12月1日起生产的第三类医疗器械、2022年6月1日起生产的第二类医疗器械都应当具有医疗器械唯一标识。
力争实现唯一标识在生产企业和产品品种的“双覆盖”,即:全省所有第三类、第二类生产企业全覆盖以及全省第三类、第二类品种全覆盖,同时鼓励第一类器械生产企业试点。
2021年12月1日起生产的第三类医疗器械、2022年6月1日起生产的第二类医疗器械都应当具有医疗器械唯一标识。
- 北京
2021年12月31日,北京市药监局发布《北京市药品监督管理局关于发布第二类医疗器械(含体外诊断试剂)注册申报事项及资料要求的通告》,要求自2022年1月1日起,第二类医疗器械产品首次注册申报,在申报资料的产品列表中要以表格形式列出拟申报产品的型号、规格、结构及组成、附件,以及每个型号规格的标识(如型号或部件的编号,UDI等)和描述说明。

- 宁夏
由于宁夏目前没有第三类医疗器械生产企业,2022年3月11日,宁夏回族自治区药监局等4部门印发《关于印发推进实施医疗器械唯一标识工作方案的通知》,提出在自治区启动第二类医疗器械唯一标识赋码试点工作,将医疗器械唯一标识的实施链条,由生产、经营环节,延伸到了二级以上公立医院等使用终端,实现全环节覆盖。
按照试点工作进度安排,预计今年7月31日前,宁夏回族自治区内参加试点的第二类医疗器械生产企业将全部完成赋码和数据上传;今年11月30日前,中卫市二级以上公立医疗机构实现医保医用耗材分类和代码与医疗器械唯一标识的关联使用,利用唯一标识开展医疗器械相关管理活动。
按照试点工作进度安排,预计今年7月31日前,宁夏回族自治区内参加试点的第二类医疗器械生产企业将全部完成赋码和数据上传;今年11月30日前,中卫市二级以上公立医疗机构实现医保医用耗材分类和代码与医疗器械唯一标识的关联使用,利用唯一标识开展医疗器械相关管理活动。

- 山东
2022年3月21日,山东省药品监督管理局印发《关于印发山东省医疗器械唯一标识(UDI)实施应用指南的通知》,提出鼓励支持第二类医疗器械注册人主动实施医疗器械唯一标识,力争2024年1月1日起生产的第二类医疗器械全部具有医疗器械唯一标识。
- 天津
2022年5月27日,天津市药品监督管理局发布《关于在第二类医疗器械注册申报时提交医疗器械唯一标识有关事项的通知》,《通知》中要求:
自2022年6月1日起,在我市申请第二类医疗器械首次注册、延续注册或者注册变更时,注册申请人/注册人应当提交其最小销售单元的产品标识。
自2022年6月1日起,在我市申请第二类医疗器械首次注册、延续注册或者注册变更时,注册申请人/注册人应当提交其最小销售单元的产品标识。
原文链接:
https://scjg.tj.gov.cn/tjsscjdglwyh_52651/tjyj/XWDT149660/GZTZ149685/202205/t20220527_5891009.html 二、已经表态要鼓励和推动二类/一、二类医疗器械实施UDI的部分省市
- 安徽
2022年5月16日安徽省药监局联合省卫生健康委、省医保局印发《安徽省推进实施医疗器械唯一标识(UDI)工作方案》《方案》明确推进医疗器械唯一标识实施工作目标:实现第三类产品实施唯一标识全覆盖;支持鼓励具备条件的第一、二类医疗器械品种注册人、经营企业和使用单位积极开展唯一标识实施工作,实现实施品种“应扫尽扫”。
原文链接:
https://mpa.ah.gov.cn/public/4140867/120977291.html
原文链接:
https://mpa.ah.gov.cn/public/4140867/120977291.html
- 江苏
2021年7月15日,江苏省药品监督管理局、江苏省卫生健康委员会江苏省医疗保障局印发《江苏省推进医疗器械唯一标识工作实施方案》《方案》中提到:
对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,在申报第二类医疗器械注册及生产许可、第三类医疗器械生产许可时,省药品监督管理局进行单独排序、优先办理。
对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,相关品种在申请全省医用耗材阳光挂网时予以优先审核办理。
原文链接:
http://da.jiangsu.gov.cn/art/2021/7/15/art_65298_9894512.html
对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,在申报第二类医疗器械注册及生产许可、第三类医疗器械生产许可时,省药品监督管理局进行单独排序、优先办理。
对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,相关品种在申请全省医用耗材阳光挂网时予以优先审核办理。
原文链接:
http://da.jiangsu.gov.cn/art/2021/7/15/art_65298_9894512.html
- 深圳
2021年12月20日,深圳市市场监督管理局、深圳市卫生健康委员会、深圳市医疗保障局联合发布《关于推进实施医疗器械唯一标识工作的通知》确定实施单位之一:
生产企业,深圳市全部第三类医疗器械生产企业和广东省质量信用A类医疗器械生产企业。
同时,鼓励深圳市第二类、第一类医疗器械注册人/备案人积极参与医疗器械唯一标识实施工作,推动第二类、第一类医疗器械赋码工作。
原文链接:
http://amr.sz.gov.cn/xxgk/qt/tzgg/content/post_9464622.html
生产企业,深圳市全部第三类医疗器械生产企业和广东省质量信用A类医疗器械生产企业。
同时,鼓励深圳市第二类、第一类医疗器械注册人/备案人积极参与医疗器械唯一标识实施工作,推动第二类、第一类医疗器械赋码工作。
原文链接:
http://amr.sz.gov.cn/xxgk/qt/tzgg/content/post_9464622.html
- 吉 林
2021年12月29日,吉林省药监局印发《吉林省推进医疗器械唯一标识系统全域试点工作方案》,《方案》提到:
第三类医疗器械(含体外诊断试剂)产品全面实施唯一标识,结合试点单位实际,鼓励我省第二类医疗器械产品逐步开展赋码。
原文链接:
http://mpa.jl.gov.cn/zxfw_84842/tzwj/202112/t20211229_8366606.html
第三类医疗器械(含体外诊断试剂)产品全面实施唯一标识,结合试点单位实际,鼓励我省第二类医疗器械产品逐步开展赋码。
原文链接:
http://mpa.jl.gov.cn/zxfw_84842/tzwj/202112/t20211229_8366606.html
- 重庆
2022年1月17日,重庆药监局发布《重庆市药品监督管理局办公室关于实施第二批医疗器械唯一标识工作有关事项的通知》:
实施第二批医疗器械唯一标识的注册人要切实落实企业主体责任,按要求做好产品唯一标识赋码、数据库上传等工作。
鼓励基于唯一标识建立健全追溯体系,做好产品召回、追踪追溯等有关工作。
鼓励和支持我市其他医疗器械品种实施唯一标识,我局将逐步推动第二类医疗器械(含体外诊断试剂)试点实施唯一标识工作。
原文链接:
http://yaojianju.cq.gov.cn/zwgk_n2104/zfxxgkml/zcwjn2104/qtwjn2104/202201/t20220118_10311075.html
实施第二批医疗器械唯一标识的注册人要切实落实企业主体责任,按要求做好产品唯一标识赋码、数据库上传等工作。
鼓励基于唯一标识建立健全追溯体系,做好产品召回、追踪追溯等有关工作。
鼓励和支持我市其他医疗器械品种实施唯一标识,我局将逐步推动第二类医疗器械(含体外诊断试剂)试点实施唯一标识工作。
原文链接:
http://yaojianju.cq.gov.cn/zwgk_n2104/zfxxgkml/zcwjn2104/qtwjn2104/202201/t20220118_10311075.html
- 河南
2022年4月28日,河南省药监局、省卫生健康委员会、省医疗保障局联合印发《河南省推进医疗器械唯一标识工作实施方案》。《方案》明确了各环节的工作任务。在生产环节,药品监管部门督促指导辖区内第三类医疗器械(含体外诊断试剂)注册人及时开展产品赋码、数据上传和维护工作,确保今年6月1日起本省生产的第三类医疗器械全部具有UDI;鼓励支持第一类、第二类医疗器械注册人、备案人积极推动实施UDI;有序推动对现有医疗器械产品UDI赋码的“能赋尽赋”。
原文链接:
https://yjj.henan.gov.cn/2022/05-16/2449587.html
原文链接:
https://yjj.henan.gov.cn/2022/05-16/2449587.html
发布于 2022-11-14 11:44・IP 属地北京





 UDI政策
UDI政策 UDI费用
UDI费用 UDI实施指导
UDI实施指导